Neuer Detektor beschleunigt die Proteinkristallographie
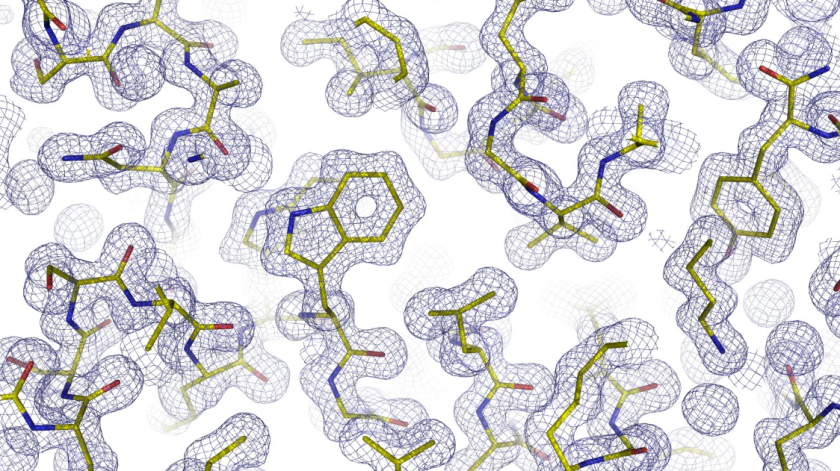
Nur 60 Sek. Messzeit mit dem neuen Detektor reichten schon aus, um die Elektrondichte des PETase-Enzyms zu ermitteln. Sie zeigt alle strukturellen Merkmale des Enzyms. © HZB

Der neue PILATUS-Detektor wurde an der MX-Beamline 14.1 in Betrieb genommen. © HZB
An einer der drei MX-Beamlines am HZB wurde letzte Woche ein neuer Detektor installiert. Im Vergleich zum alten Detektor ist der neue besser, schneller und empfindlicher. Er ermöglicht es, binnen kürzester Zeit vollständige Datensätze von komplexen Proteinen aufzunehmen.
Proteine bestehen aus tausenden von Bausteinen, die komplexe Architekturen mit gefalteten oder verwickelten Bereichen bilden können. Für die Funktion des Proteins im Organismus spielt ihre Gestalt jedoch die entscheidende Rolle. Mit Hilfe der makromolekularen Kristallographie an BESSY II ist es möglich, die Architektur von Proteinmolekülen zu entschlüsseln. Dafür werden winzige Proteinkristalle mit Röntgenlicht aus der Synchrotronquelle BESSY II durchleuchtet. Aus den gewonnenen Beugungsmustern lässt sich die Morphologie der Moleküle errechnen.
Nun hat das MX-Team an BESSY II an der MX-Beamline 14.1 einen neuen Detektor in Betrieb genommen, der zwei- bis dreimal schneller als bisher arbeitet. Als Probe analysierte das Team einen Kristall aus dem Enzym PETase. PETase ist in der Lage, den Kunststoff PET teilweise abzubauen. In weniger als einer Minute konnte der Detektor einen vollständigen Beugungsdatensatz aufzeichnen, der Daten aus einem Winkelbereich von 180 Grad umfasst. Der Datensatz besteht aus 1200 Bildern, die jeweils 45 Millisekunden lang der Röntgenstrahlung ausgesetzt waren. „Die resultierende Elektronendichte war von ausgezeichneter Qualität und zeigte alle strukturellen Merkmale des Enzyms“, erklärt Dr. Manfred Weiss, der das MX-Team an BESSY II leitet.
Der Erfolg der HZB MX-Beamlines wird durch mehr als 3000 PDB-Einträge aus experimenteller Strahlzeit von mehr als hundert internationalen Nutzergruppen aus dem akademischen Bereich und pharmazeutischen Forschungsunternehmen dokumentiert.
red.
-
Gefriergussverfahren – Eine Anleitung für komplex strukturierte Materialien
Gefriergussverfahren sind ein kostengünstiger Weg, um hochporöse Materialien mit hierarchischer Architektur, gerichteter Porosität und multifunktionalen inneren Oberflächen herzustellen. Gefriergegossene Materialien eignen sich für viele Anwendungen, von der Medizin bis zur Umwelt- und Energietechnik. Ein Beitrag im Fachjournal „Nature Reviews Methods Primer“ vermittelt nun eine Anleitung zu Gefriergussverfahren, zeigt einen Überblick, was gefriergegossene Werkstoffe heute leisten, und skizziert neue Einsatzbereiche. Ein besonderer Fokus liegt auf der Analyse dieser Materialien mit Tomoskopie.
-
IRIS-Beamline an BESSY II mit Nanomikroskopie erweitert
Die Infrarot-Beamline IRIS am Speicherring BESSY II bietet nun eine vierte Option, um Materialien, Zellen und sogar Moleküle auf verschiedenen Längenskalen zu charakterisieren. Das Team hat die IRIS-Beamline mit einer Endstation für Nanospektroskopie und Nanoimaging erweitert, die räumliche Auflösungen bis unter 30 Nanometer ermöglicht. Das Instrument steht auch externen Nutzergruppen zur Verfügung.
-
Einfachere Herstellung von anorganischen Perowskit-Solarzellen bringt Vorteile
Anorganische Perowskit-Solarzellen aus CsPbI3 sind langzeitstabil und erreichen gute Wirkungsgrade. Ein Team um Prof. Antonio Abate hat nun an BESSY II Oberflächen und Grenzflächen von CsPbI3 -Schichten analysiert, die unter unterschiedlichen Bedingungen produziert wurden. Die Ergebnisse belegen, dass das Ausglühen in Umgebungsluft die optoelektronischen Eigenschaften des Halbleiterfilms nicht negativ beeinflusst, sondern sogar zu weniger Defekten führt. Dies könnte die Massenanfertigung von anorganischen Perowskit-Solarzellen weiter vereinfachen.
